Рак шейки матки — Википедия
Рак ше́йки ма́тки — злокачественное новообразование, возникающее в области шейки матки. Гистологически различают две его основные разновидности: аденокарцинома и плоскоклеточный рак. В настоящее время считается доказанной связь заболеваемости вирусом папилломы человека и риском развития рака шейки матки.[2]
Исследования вопроса заболеваемости раком шейки матки проводились ещё в XIX веке, и полученные результаты показывали связь активности половой жизни и частоты встречаемости рака. Современные исследования подтверждают эти данные, наблюдается связь между частотой смены половых партнёров и риском заболевания раком шейки матки.[3] В России в 2002 году было зарегистрировано 12 285 случаев заболевания раком шейки матки.[4] Данное заболевание наиболее часто встречается у женщин среднего возраста (35—55 лет), в 20 % случаев обнаруживается в возрасте старше 65 лет, в молодом возрасте встречается относительно редко. Заболеваемость раком шейки матки значительно превышает заболеваемость другими опухолями женской половой системы.[4] В начале XXI века отмечается увеличение больных раком шейки матки на поздних стадиях: доля рака IV стадии, по разным данным, составляет 37,1 % — 47,3 %.[2][5]
При классификации рака шейки матки используется стандартная TNM-классификация злокачественных новообразований.[6]
- Тх — недостаточно данных для оценки опухоли.
- Т0 — первичная опухоль не определяется.
- Tis — карцинома преинвазивная. Стадия по FIGO 0
- Т1 — Рак, ограниченный шейкой матки (без учёта тела матки). Стадия по FIGO 1
- Т1а — Инвазивная опухоль, обнаруживается только микроскопически. Стадия по FIGO 1а
- Т1а1 — Инвазия в строму до 3,0 мм в глубину и до 5,0 мм поверхности. Стадия по FIGO 1а 1
- Т1а2 — Инвазия в строму до 5,0 мм в глубину и до 7,0 мм по поверхности. Стадия по FIGO 1а 2
- T1b — Клинически определяемый очаг поражения, ограниченный шейкой матки или микроскопически определяемое поражение большего размера, чем Т1А/1A2. Стадия по FIGO 1b
- T1b1 — Клинически определяемый очаг поражения более 5,0 мм до 4,0 см в наибольшем измерении. Стадия по FIGO 1b1
- T1b2 — Клинически определяемый очаг поражения более 4,0 см. Стадия по FIGO 1b1
- Т2 — Опухоль шейки матки с распространением за пределы матки, но без прорастания стенки таза или нижней трети влагалища. Стадия по FIGO 2
- T2a — Без инвазии в параметрий. Стадия по FIGO 2a
- T2b — С инвазией в параметрий. Стадия по FIGO 2b.
- Т3 — Рак шейки матки с распространением на стенку таза, поражение нижней трети влагалища, нарушение функции почки. Стадия по FIGO 3.
- Т3а — Опухоль поражает нижнюю треть влагалища, но не распространяется на стенку таза, и не повреждает почки. Стадия по FIGO 3a.
- T3b — Опухоль распространяется на стенку таза и/или приводит к гидронефрозу и нефункционирующей почке. Стадия по FIGO 3b.
- Т4 — Опухоль распространяется на слизистую оболочку мочевого пузыря или прямой кишки и/или выходит за пределы малого таза. Стадия по FIGO 4а.
- M1 — Отдалённые метастазы. Стадия по FIGO 4b.
FIGO – the International Federation of Gynecology and Obstetrics.
В настоящее время выявлены факторы, которые повышают риск заболевания раком шейки матки. К ним относятся[2][7]:
- Раннее начало половой жизни (до 16 лет).
- Частая смена сексуальных партнёров (более 2—3 в год).
- Курение.
- Инфицирование вирусом папилломы человека.
В большинстве случаев фактором риска развития рака является вирус папилломы человека 16-го и 18-го серотипов. Вирусы данных серотипов ответственны за 65—75 % случаев возникновения рака шейки матки. Заражение вирусом папилломы человека происходит преимущественно половым путём, а барьерные средства контрацепции зачастую обладают недостаточной эффективностью в защите от инфицирования ВПЧ.[7]
Несмотря на то, что инфицирование при половом контакте с носителем ВПЧ достигает 75 %, в 90 % случаев вирус достаточно быстро уничтожается иммунной системой, и только если вирусу удаётся преодолеть иммунную защиту, развивается персистирующее течение заболевания, сопровождающееся изменениями в эпителии шейки матки.[7]
Исследования ВОЗ показали, что женщина, имевшая в течение жизни более 10 половых партнёров, имеет в 3 раза больший риск заболеть раком шейки матки. Также у женщин, страдающих ВПЧ, их постоянные половые партнёры в 5 раз чаще, чем мужчины в прочей популяции, имели более 20 половых партнёров.[7]
Злокачественные новообразования возникают в результате повреждения механизмов апоптоза. В случае рака шейки матки антионкогенную активность проявляют гены p53 Rb. При персистирующей инфекции вирусом папилломы человека эти антионкогены блокируются белками, производимыми вирусными генами Е5 и Е6. Белок, синтезируемый геном Е6, инактивирует опухолевый супрессор, запускающий механизм клеточной смерти бесконтрольно пролиферирующих клеток. Кроме того, данный белок активирует теломеразу, что увеличивает шансы возникновения бессмертных клонов клеток и, как следствие, развития злокачественных образований. Белок, синтезируемый геном Е6, не активен в отсутствие белка, синтезируемого геном Е7. Белок, вырабатываемый геном Е7, способен и самостоятельно вызывать опухолевую трансформацию клеток, но его действие значительно усиливается в присутствии белка, синтезируемого Е6. Блок Е7 блокирует циклин-зависимые киназы р21 и р26, что позволяет повреждённой клетке начать делиться. Таким образом мы видим, что вирус папилломы человека в результате своей жизнедеятельности повреждает противоопухолевую защиту клетки, значительно увеличивая риск развития злокачественных новообразований.[7][8]
Симптоматика на ранних стадиях может отсутствовать или проявляться в виде трудно дифференцируемого дискомфорта. На более поздних стадиях развития заболевания могут возникать следующие клинические признаки.[9]
- Патологические вагинальные кровотечения.
- Кровотечения после полового акта, спринцевания или вагинального осмотра гинекологом.
- Изменения характера и длительности менструации.
- Возникновение кровянистого отделяемого во влагалище после наступления менопаузы.
- Боль в области малого таза.
- Боль во время полового акта.
Все приведённые выше клинические признаки неспецифичны. Также развитие рака шейки матки может сопровождаться системными эффектами, например:
Отсутствие характерных клинических признаков и отсутствие жалоб в дебюте заболевания значительно затрудняют раннюю диагностику и при отсутствии регулярного гинекологического осмотра приводят к поздней диагностике заболевания, значительно ухудшающей прогноз выздоровления.
В связи со стёртостью клинических проявлений и отсутствием специфической клиники наиболее эффективным методом диагностики являются регулярные гинекологические осмотры, призванные выявить ранние стадии злокачественных новообразований.[2]
Скрининговым методом, позволяющим выявить рак шейки матки на разных стадиях развития, является цитологическое исследование. Данные сравнительного анализа показывают, что оптимальным по эффективности и трудозатратам является обследование раз в 2—3 года. Ежегодные обследования увеличивают трудозатраты в 3 раза, а частота обнаружения новообразований возрастает только на 2 %. Достаточно часто в поздней диагностике виноваты сами больные, когда они, при обнаружении у себя бессимптомно текущего рака шейки матки, своевременно не начинают лечение и обращаются за медицинской помощью на поздних стадиях, когда эффективность терапии во много раз ниже, чем на ранних этапах.[2]
Основным методом диагностики является кольпоскопия, которая по мере необходимости расширяется различными дополнительными манипуляциями. Так, в случае скрининга проводится цитологическое исследование мазков отпечатков. Также шейка матки может обрабатываться уксусной кислотой для выявления плоских кондиллом, которые будут проявляется как пятна другого цвета, на поверхности нормальной шейки. В случае подозрения на наличие атипичных клеток проводится кольпоскопия с биопсией. Признаком предраковых состояний является обнаруживаемый при цитологическом обследовании пойкилоцитоз. Предраковые состояния не всегда приводят к развитию злокачественных новообразований, но их наличие является плохим прогностическим признаком в отношении риска возникновения рака шейки матки.[2]
Лечение рака шейки матки комплексное, оно может сочетать в себе хирургическое лечение, лучевую терапию и химиотерапию.[10] Ранее считалось, что наиболее эффективным при лечении рака шейки матки является сочетание хирургического и лучевого методов лечения. Ряд исследований, проведённых в 1999—2000 годах, показал, что добавление химиотерапии значительно повышает эффективность лучевой терапии.[11]
Комбинированное лечение показано во всех случаях наличия регионарного метастазирования.
Хирургическое лечение[править | править код]
При распространённых инвазивных формах рака шейки матки применяется расширенная гистероэктомия по методу Вертгейма—Мейгса, суть которой заключается в одномоментном иссечении тазовой клетчатки с заключёнными в ней лимфоузлами, удалении матки с придатками и не менее трети влагалищной трубки. В некоторых случаях производится экзентерация таза, но в настоящее время данный метод применяется относительно редко в связи с его высокой травматичностью для больной и эффективностью, незначительно превышающей гистероэктомию.[10]
Лучевая терапия[править | править код]
Лучевая терапия является ведущим методом лечения рака шейки матки и зачастую, в сочетании с химиотерапией, единственно возможным на 3—4 стадии в связи с невозможностью хирургического вмешательства. Применяется дистанционная гамма-терапия. Разовая доза, подаваемая на область воздействия, составляет 2 грей. Как правило, дистанционная гамма терапия сочетается с внутриполостным облучением шейки матки.[10]
Химиотерапия[править | править код]
В сочетании с лучевой терапией проводится полихимиотерапия несколькими цитостатическими препаратами. С одной стороны, эта терапия позволяет повысить эффективность лучевой терапии, добиться снижения дозы облучения и снизить шансы возникновения радиоиндуцированных опухолей. С другой стороны, сочетание химио- и лучевой терапии плохо переносится больными и приводит к усилению побочных эффектов. Ряд специалистов придерживаются мнения, что курсовая полихимиотерапия в сочетании с лучевой терапией малоэффективна и даже опасна.
Однако многие специалисты сходятся во мнении, что регионарная внутриартериальная химиотерапия цитостатиками желательна при проведении лучевой терапии, исследования показали повышение выживаемости больных, получавших подобное сочетание.[10]
Считается доказанной эффективность введения на фоне проведения лучевой терапии препаратов платины (цисплатин).[10]
Иммунотерапия[править | править код]
В настоящее время активно изучается вопрос сохранения иммунитета при лучевой и химиотерапии с целью обеспечения возможности организму задействовать и свои противоопухолевые механизмы. Считается, что относительно эффективным является введение интерферонов; относительно дозировки препаратов в научной среде идут активные дискуссии, и единого консенсусного мнения в настоящее время не существует.[10]
Важную роль в профилактике рака шейки матки играет профилактика заражения вирусом папилломы человека. В настоящее время в России рекомендована вакцинопрофилактика папилломавирусной инфекции девочкам 13—15 лет. В некоторых странах прививают и мальчиков препубертатного возраста, с целью сократить циркуляцию вируса папилломы. Вакцинация проводится вакцинами Гардасил с интервалом 0-2-6 или Церварикс с интервалом 0-1-6.
Прогноз условно благоприятен и зависит от стадии, на которой было выявлено заболевание. В России относительная пятилетняя выживаемость на ранних стадиях составляет около 92 %. Общая выживаемость, включающая и поздние стадии заболевания, составляет 72 %.[4] По данным других источников, 5-летняя выживаемость при первой стадии составляет 78,1 %, при второй — 57 %, при третьей — 31 %, при четвёртой — 7,8 %.[5]
- ↑ 1 2 Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ 1 2 3 4 5 6 (PDF) Новик, В. И. Эпидемиология рака шейки матки. Факторы риска скрининг (неопр.). «Практическая онкология». Т. 3, № 2 (2002). Дата обращения 8 июня 2009. Архивировано 1 марта 2004 года.
- ↑ Предрак и рак шейки матки (неопр.). ЦИР. Дата обращения 8 июня 2009. Архивировано 1 апреля 2012 года.
- ↑ 1 2 3 www.medmax.ru Рак шейки матки, симптомы, лечение (неопр.) (недоступная ссылка). Дата обращения 8 июня 2009. Архивировано 11 июня 2009 года.
- ↑ 1 2 Черкасский областной онкологический диспансер. Этиология и патогенез рака шейки матки. (неопр.) (недоступная ссылка). Дата обращения 8 июня 2009. Архивировано 4 июля 2009 года.
- ↑ Рак шейки матки. Классификация
- ↑ 1 2 3 4 5 (PDF) Гурцевич, В. Э. Рак шейки матки: Причины, следствия, профилактика (неопр.) (недоступная ссылка). Журнал «СПИД, рак и общественное здоровье». Т. 11, № 1 (2007). Дата обращения 8 июня 2009. Архивировано 24 февраля 2015 года.
- ↑ Хансон, К. П. Современные представление о канцерогенезе рака шейки матки. (неопр.). Журнал «Практическая онкология» том 3 № 3 (2002). Дата обращения 9 июня 2009. Архивировано 8 ноября 2005 года.
- ↑ Симптомы рака шейки матки
- ↑ 1 2 3 4 5 6 (PDF) Максимов, С. Я. Комбинированное лечение рака шейки матки (неопр.). «Практическая онкология». Т. 3, № 3 (2002). Дата обращения 8 июня 2009. Архивировано 8 ноября 2005 года.
- ↑ ASCO 2001: рак яичников и шейки матки. Тюляндин С. А. Российский онкологический научный центр им. Н. Н. Блохина РАМН, Москва
- Шайн А. А. Онкология. Учебник для студентов медицинских вузов. — Медицинское информационное агентство, 2004. — 544 с.
- Ганцев Ш. X. Онкология. Учебник для студентов медицинских вузов. — 2-е издание, исправленное и дополненное. — Москва: Медицинское информационное агентство, 2006. — 488 с. — ISBN 5-89481-418-9.
Карцинома эндометрия — Википедия
Материал из Википедии — свободной энциклопедии
Карцинома эндометрия (тж. рак тела матки, лат. Carcinoma corporis uteri) — онкологическое заболевание, развивающееся в эпителиальном слое тела матки [2].
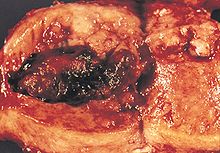 Аденокарцинома эндометрия в патологоанатомическом препарате
Аденокарцинома эндометрия в патологоанатомическом препарате
Существуют определённые факторы риска, которые могут с большей вероятностью привести к развитию рака матки. Среди них:
- Чрезмерный рост клеток эндометрия (гиперплазия эндометрия). Гиперплазия ещё не является раком, но иногда может подвергаться озлокачествлению. Частыми признаками этого состояния являются: длительные и обильные менструации, кровянистые выделения между менструациями и кровотечения после менопаузы. Гиперплазия эндометрия — нередкое состояние у женщин после 40 лет.
- Ожирение. Женщины с ожирением имеют больший риск развития рака эндометрия.
- Отягощённый репродуктивный и менструальный анамнез: женщины, у которых никогда не было детей, либо менструации начались до 12 лет, либо продолжались после 55 лет.
- Прием гормональных контрацептивов на основе только эстрогена, без добавления прогестерона в анамнезе.
- Прием тамоксифена (с целью профилактики или лечения рака молочной железы) в анамнезе.
- Лучевая терапия органов малого таза в анамнезе.
- Отягощённый семейный анамнез: женщины, у которых у матери, сестры или дочери имели случаи рака эндометрия находятся в зоне риска, а также женщины с наследственной формой рака толстой кишки (синдром Линча).
- Постменопауза
Наиболее частый симптом рака матки — патологические кровянистые выделения из влагалища. Выделения могут быть водянистыми с примесью крови, затем переходить в кровотечение. Кровотечения из половых путей после менопаузы являются патологией.
Также симптомами карциномы эндометрия могут быть боль и затруднения при мочеиспускании, боль во время полового акта, боль в области таза. Эти симптомы могут быть вызваны как раком эндометрия, так и другими заболеваниями.
Определение стадии[править | править код]
Карцинома эндометрия с хирургической точки зрения может быть классифицирована с помощью системы определения стадии онкологических заболеваний FIGO.
- Стадия I
- IA: опухоль располагается только в эндометрии
- IB: инвазия опухоли на менее чем половину миометрия
- IC: инвазия опухоли на более чем половину миометрия
- Стадия II
- IIA: поражение только цилиндра шейки матки
- IIB: инвазия в строму шейки матки
- Стадия III
- IIIA: переход опухоли на серозную оболочку и придатки (маточные трубы и яичники), или злокачественные клетки присутствуют в перитонеальной жидкости
- IIIB: имеются метастазы во влагалище
- IIIC: метастазы в подвздошных околопупочных или парааортальных лимфатических узлах
- Стадия IV
- Бохман Я. В. Руководство по онкогинекологии. – Рипол Классик, 1989.
- Козаченко В. П. Онкогинекология: руководство для врачей //М: Медицина. – 2006. – Т. 560.
- Павлова Т. Д. Онкогинекология: учебное пособие для врачей онкогинекологов и акушеров-гинекологов //Харьков: Каравелла. – 2006.
- Практическая онкогинекология: избранные лекции. – Центр ТОММ, 2008.
- Полякова В. А. Онкогинекология. Руководство для врачей //М.: Медицинская книга. – 2001. – С. 73-91.
Рак шейки матки — Википедия
Рак ше́йки ма́тки — злокачественное новообразование, возникающее в области шейки матки. Гистологически различают две его основные разновидности: аденокарцинома и плоскоклеточный рак. В настоящее время считается доказанной связь заболеваемости вирусом папилломы человека и риском развития рака шейки матки.[1]
Значимость и распространённость
Исследования вопроса заболеваемости раком шейки матки проводились ещё в XIX веке, и полученные результаты показывали связь активности половой жизни и частоты встречаемости рака. Современные исследования подтверждают эти данные, наблюдается связь между частотой смены половых партнёров и риском заболевания раком шейки матки.[2] В России в 2002 году было зарегистрировано 12 285 случаев заболевания раком шейки матки.[3] Данное заболевание наиболее часто встречается у женщин среднего возраста (35—55 лет), в 20 % случаев обнаруживается в возрасте старше 65 лет, в молодом возрасте встречается относительно редко. Следует отметить, что заболеваемость раком шейки матки значительно превышает заболеваемость другими опухолями женской половой системы.[3] В начале XXI века отмечается увеличение больных раком шейки матки на поздних стадиях: доля рака IV стадии, по разным данным, составляет 37,1 % — 47,3 %.[1][4]
Классификация
При классификации рака шейки матки используется стандартная TNM-классификация злокачественных новообразований.[5]
- Тх — недостаточно данных для оценки опухоли.
- Т0 — первичная опухоль не определяется.
- Tis — карцинома преинвазивная. Стадия по FIGO 0
- Т1 — Рак, ограниченный шейкой матки (без учёта тела матки). Стадия по FIGO 1
- Т1а — Инвазивная опухоль, обнаруживается только микроскопически. Стадия по FIGO 1а
- Т1а1 — Инвазия в строму до 3,0 мм в глубину и до 7,0 мм поверхности. Стадия по FIGO 1а 1
- Т1а2 — Инвазия в строму до 5,0 мм в глубину и до 7,0 мм по поверхности. Стадия по FIGO 1а 2
- T1b — Клинически определяемый очаг поражения, ограниченный шейкой матки или микроскопически определяемое поражение большего размера, чем Т1А/1A2. Стадия по FIGO 1b
- T1b1 — Клинически определяемый очаг поражения до 4,0 см в наибольшем измерении. Стадия по FIGO 1b1
- T1b2 — Клинически определяемый очаг поражения более 4,0 см. Стадия по FIGO 1b1
- Т2 — Опухоль шейки матки с распространением за пределы матки, но без прорастания стенки таза или нижней трети влагалища. Стадия по FIGO 2
- T2a — Без инвазии в параметрий. Стадия по FIGO 2a
- T2b — С инвазией в параметрий. Стадия по FIGO 2b.
- Т3 — Рак шейки матки с распространением на стенку таза, поражение нижней трети влагалища, нарушение функции почки. Стадия по FIGO 3.
- Т3а — Опухоль поражает нижнюю треть влагалища, но не распространяется на стенку таза, и не повреждает почки. Стадия по FIGO 3a.
- T3b — Опухоль распространяется на стенку таза и/или приводит к гидронефрозу и нефункционирующей почке. Стадия по FIGO 3b.
- Т4 — Опухоль распространяется на слизистую оболочку мочевого пузыря или прямой кишки и/или выходит за пределы малого таза. Стадия по FIGO 4а.
- M1 — Отдалённые метастазы. Стадия по FIGO 4b.
FIGO – the International Federation of Gynecology and Obstetrics.
Этиология
В настоящее время выявлены факторы, которые повышают риск заболевания раком шейки матки. К ним относятся[1][6]:
- Раннее начало половой жизни (до 16 лет).
- Частая смена сексуальных партнёров (более 2—3 в год).
- Курение.
- Инфицирование вирусом папилломы человека.
В большинстве случаев фактором риска развития рака является вирус папилломы человека 16-го и 18-го серотипов. Вирусы данных серотипов ответственны за 65—75 % случаев возникновения рака шейки матки. Заражение вирусом папилломы человека происходит преимущественно половым путём, а барьерные средства контрацепции зачастую обладают недостаточной эффективностью в защите от инфицирования ВПЧ.[6]
Несмотря на то, что инфицирование при половом контакте с носителем ВПЧ достигает 75 %, в 90 % случаев вирус достаточно быстро уничтожается иммунной системой, и только если вирусу удаётся преодолеть иммунную защиту, развивается персистирующее течение заболевания, сопровождающееся изменениями в эпителии шейки матки.[6]
Следует отметить, что исследования ВОЗ показали, что женщина, имевшая в течение жизни более 10 половых партнёров, имеет в 3 раза больший риск заболеть раком шейки матки. Также следует отметить, что у женщин, страдающих ВПЧ, их постоянные половые партнёры в 5 раз чаще, чем мужчины в прочей популяции, имели более 20 половых партнёров.[6]
Патогенез
Злокачественные новообразования возникают в результате повреждения механизмов апоптоза. В случае рака шейки матки антионкогенную активность проявляют гены p53 Rb. При персистирующей инфекции вирусом папилломы человека эти антионкогены блокируются белками, производимыми вирусными генами Е5 и Е6. Белок, синтезируемый геном Е6, инактивирует опухолевый супрессор, запускающий механизм клеточной смерти бесконтрольно пролиферирующих клеток. Кроме того, данный белок активирует теломеразу, что увеличивает шансы возникновения бессмертных клонов клеток и, как следствие, развития злокачественных образований. Следует отметить, что белок, синтезируемый геном Е6, не активен в отсутствие белка, синтезируемого геном Е7. Белок, вырабатываемый геном Е7, способен и самостоятельно вызывать опухолевую трансформацию клеток, но его действие значительно усиливается в присутствии белка, синтезируемого Е6. Блок Е7 блокирует циклин-зависимые киназы р21 и р26, что позволяет повреждённой клетке начать делиться. Таким образом мы видим, что вирус папилломы человека в результате своей жизнедеятельности повреждает противоопухолевую защиту клетки, значительно увеличивая риск развития злокачественных новообразований.[6][7]
Клиническая картина
Симптоматика на ранних стадиях может отсутствовать или проявляться в виде трудно дифференцируемого дискомфорта. На более поздних стадиях развития заболевания могут возникать следующие клинические признаки.[8]
- Патологические вагинальные кровотечения.
- Кровотечения после полового акта, спринцевания или вагинального осмотра гинекологом.
- Изменения характера и длительности менструации.
- Возникновение кровянистого отделяемого во влагалище после наступления менопаузы.
- Боль в области малого таза.
- Боль во время полового акта.
Все приведённые выше клинические признаки неспецифичны. Также развитие рака шейки матки может сопровождаться системными эффектами, например:
Отсутствие характерных клинических признаков и отсутствие жалоб в дебюте заболевания значительно затрудняют раннюю диагностику и при отсутствии регулярного гинекологического осмотра приводят к поздней диагностике заболевания, значительно ухудшающей прогноз выздоровления.
Диагностика
В связи со стёртостью клинических проявлений и отсутствием специфической клиники наиболее эффективным методом диагностики являются регулярные гинекологические осмотры, призванные выявить ранние стадии злокачественных новообразований.[1]
Скрининговым методом, позволяющим выявить рак шейки матки на разных стадиях развития, является цитологическое исследование. Данные сравнительного анализа показывают, что оптимальным по эффективности и трудозатратам является обследование раз в 2—3 года. Ежегодные обследования увеличивают трудозатраты в 3 раза, а частота обнаружения новообразований возрастает только на 2 %. Следует отметить, что достаточно часто в поздней диагностике виноваты сами больные, когда они, при обнаружении у себя бессимптомно текущего рака шейки матки, своевременно не начинают лечение и обращаются за медицинской помощью на поздних стадиях, когда эффективность терапии в разы ниже, чем на ранних этапах.[1]
Основным методом диагностики является кольпоскопия, которая по мере необходимости расширяется различными дополнительными манипуляциями. Так, в случае скрининга проводится цитологическое исследование мазков отпечатков. Также шейка матки может обрабатываться уксусной кислотой для выявления плоских кондиллом, которые будут проявляется как пятна другого цвета, на поверхности нормальной шейки. В случае подозрения на наличие атипичных клеток проводится кольпоскопия с биопсией. Признаком предраковых состояний является обнаруживаемый при цитологическом обследовании пойкилоцитоз. Следует отметить, что предраковые состояния не всегда приводят к развитию злокачественных новообразований, но их наличие является плохим прогностическим признаком в отношении риска возникновения рака шейки матки.[1]
Лечение
Лечение рака шейки матки комплексное, оно может сочетать в себе хирургическое лечение, лучевую терапию и химиотерапию.[9] Ранее считалось, что наиболее эффективным при лечении рака шейки матки является сочетание хирургического и лучевого методов лечения. Ряд исследований, проведённых в 1999—2000 годах, показал, что добавление химиотерапии значительно повышает эффективность лучевой терапии.[10]
Комбинированное лечение показано во всех случаях наличия регионарного метастазирования.
Хирургическое лечение
При распространённых инвазивных формах рака шейки матки применяется расширенная гистероэктомия по методу Вертгейма—Мейгса, суть которой заключается в одномоментном иссечении тазовой клетчатки с заключёнными в ней лимфоузлами, удалении матки с придатками и не менее трети влагалищной трубки. В некоторых случаях производится экзентерация таза, но в настоящее время данный метод применяется относительно редко в связи с его высокой травматичностью для больного и эффективностью, незначительно превышающей гистероэктомию.[9]
Лучевая терапия
Лучевая терапия является ведущим методом лечения рака шейки матки и зачастую, в сочетании с химиотерапией, единственно возможным на 3—4 стадии в связи с невозможностью хирургического вмешательства. Применяется дистанционная гамма-терапия. Разовая доза, подаваемая на область воздействия, составляет 2 грей. Как правило, дистанционная гамма терапия сочетается с внутриполостным облучением шейки матки.[9]
Химиотерапия
В сочетании с лучевой терапией проводится полихимиотерапия несколькими цитостатическими препаратами. С одной стороны, эта терапия позволяет повысить эффективность лучевой терапии, добиться снижения дозы облучения и снизить шансы возникновения радиоиндуцированных опухолей. С другой стороны, сочетание химио- и лучевой терапии плохо переносится больными и приводит к усилению побочных эффектов. Ряд специалистов придерживаются мнения, что курсовая полихимиотерапия в сочетании с лучевой терапией малоэффективна и даже опасна.
Однако многие специалисты сходятся во мнении, что регионарная внутриартериальная химиотерапия цитостатиками желательна при проведении лучевой терапии, исследования показали повышение выживаемости больных, получавших подобное сочетание.[9]
Считается доказанной эффективность введения на фоне проведения лучевой терапии препаратов платины (цисплатин).[9]
Иммунотерапия
В настоящее время активно изучается вопрос сохранения иммунитета при лучевой и химиотерапии с целью обеспечения возможности организму задействовать и свои противоопухолевые механизмы. Считается, что относительно эффективным является введение интерферонов; относительно дозировки препаратов в научной среде идут активные дискуссии, и единого консенсусного мнения в настоящее время не существует.[9]
Профилактика
Важную роль в профилактике рака шейки матки играет профилактика заражения вирусом папилломы человека. В настоящее время в России рекомендована вакцинопрофилактика папилломавирусной инфекции девочкам 13—15 лет. В некоторых странах прививают и мальчиков препубертатного возраста, с целью сократить циркуляцию вируса папилломы. Вакцинация проводится вакцинами Гардасил с интервалом 0-2-6 или Церварикс с интервалом 0-1-6.
Прогноз
Прогноз условно благоприятен и зависит от стадии, на которой было выявлено заболевание. В России относительная пятилетняя выживаемость на ранних стадиях составляет около 92 %. Общая выживаемость, включающая и поздние стадии заболевания, составляет 72 %.[3] По данным других источников, 5-летняя выживаемость при первой стадии составляет 78,1 %, при второй — 57 %, при третьей — 31 %, при четвёртой — 7,8 %.[4]
Примечания
- ↑ 1 2 3 4 5 6 (PDF) Новик, В. И. Эпидемиология рака шейки матки. Факторы риска скрининг (недоступная ссылка — история). «Практическая онкология». Т. 3, № 2 (2002). Проверено 8 июня 2009. Архивировано 1 марта 2004 года.
- ↑ Предрак и рак шейки матки. ЦИР. Проверено 8 июня 2009. Архивировано 2 апреля 2012 года.
- ↑ 1 2 3 www.medmax.ru Рак шейки матки, симптомы, лечение
- ↑ 1 2 Черкасский областной онкологический диспансер. Этиология и патогенез рака шейки матки.
- ↑ Рак шейки матки. Классификация
- ↑ 1 2 3 4 5 (PDF) Гурцевич, В. Э. Рак шейки матки: Причины, следствия, профилактика (недоступная ссылка — история). Журнал «СПИД, рак и общественное здоровье». Т. 11, № 1 (2007). Проверено 8 июня 2009.
- ↑ Хансон, К. П. Современные представление о канцерогенезе рака шейки матки. (недоступная ссылка — история). Журнал «Практическая онкология» том 3 № 3 (2002). Проверено 9 июня 2009. Архивировано 8 ноября 2005 года.
- ↑ Симптомы рака шейки матки
- ↑ 1 2 3 4 5 6 (PDF) Максимов, С. Я. Комбинированное лечение рака шейки матки (недоступная ссылка — история). «Практическая онкология». Т. 3, № 3 (2002). Проверено 8 июня 2009. Архивировано 8 ноября 2005 года.
- ↑ ASCO 2001: рак яичников и шейки матки. Тюляндин С. А. Российский онкологический научный центр им. Н. Н. Блохина РАМН, Москва
Ссылки
Литература
- Шайн А. А. Онкология. Учебник для студентов медицинских вузов. — Медицинское информационное агентство, 2004. — 544 с.
- Ганцев Ш. X. Онкология. Учебник для студентов медицинских вузов. — 2-е издание, исправленное и дополненное. — Москва: Медицинское информационное агентство, 2006. — 488 с. — ISBN 5-89481-418-9.
Рак шейки матки — Википедия
Рак ше́йки ма́тки — злокачественное новообразование, возникающее в области шейки матки. Гистологически различают две его основные разновидности: аденокарцинома и плоскоклеточный рак. В настоящее время считается доказанной связь заболеваемости вирусом папилломы человека и риском развития рака шейки матки.[1]
Значимость и распространённость
Исследования вопроса заболеваемости раком шейки матки проводились ещё в XIX веке, и полученные результаты показывали связь активности половой жизни и частоты встречаемости рака. Современные исследования подтверждают эти данные, наблюдается связь между частотой смены половых партнёров и риском заболевания раком шейки матки.[2] В России в 2002 году было зарегистрировано 12 285 случаев заболевания раком шейки матки.[3] Данное заболевание наиболее часто встречается у женщин среднего возраста (35—55 лет), в 20 % случаев обнаруживается в возрасте старше 65 лет, в молодом возрасте встречается относительно редко. Следует отметить, что заболеваемость раком шейки матки значительно превышает заболеваемость другими опухолями женской половой системы.[3] В начале XXI века отмечается увеличение больных раком шейки матки на поздних стадиях: доля рака IV стадии, по разным данным, составляет 37,1 % — 47,3 %.[1][4]
Классификация
При классификации рака шейки матки используется стандартная TNM-классификация злокачественных новообразований.[5]
- Тх — недостаточно данных для оценки опухоли.
- Т0 — первичная опухоль не определяется.
- Tis — карцинома преинвазивная. Стадия по FIGO 0
- Т1 — Рак, ограниченный шейкой матки (без учёта тела матки). Стадия по FIGO 1
- Т1а — Инвазивная опухоль, обнаруживается только микроскопически. Стадия по FIGO 1а
- Т1а1 — Инвазия в строму до 3,0 мм в глубину и до 7,0 мм поверхности. Стадия по FIGO 1а 1
- Т1а2 — Инвазия в строму до 5,0 мм в глубину и до 7,0 мм по поверхности. Стадия по FIGO 1а 2
- T1b — Клинически определяемый очаг поражения, ограниченный шейкой матки или микроскопически определяемое поражение большего размера, чем Т1А/1A2. Стадия по FIGO 1b
- T1b1 — Клинически определяемый очаг поражения до 4,0 см в наибольшем измерении. Стадия по FIGO 1b1
- T1b2 — Клинически определяемый очаг поражения более 4,0 см. Стадия по FIGO 1b1
- Т2 — Опухоль шейки матки с распространением за пределы матки, но без прорастания стенки таза или нижней трети влагалища. Стадия по FIGO 2
- T2a — Без инвазии в параметрий. Стадия по FIGO 2a
- T2b — С инвазией в параметрий. Стадия по FIGO 2b.
- Т3 — Рак шейки матки с распространением на стенку таза, поражение нижней трети влагалища, нарушение функции почки. Стадия по FIGO 3.
- Т3а — Опухоль поражает нижнюю треть влагалища, но не распространяется на стенку таза, и не повреждает почки. Стадия по FIGO 3a.
- T3b — Опухоль распространяется на стенку таза и/или приводит к гидронефрозу и нефункционирующей почке. Стадия по FIGO 3b.
- Т4 — Опухоль распространяется на слизистую оболочку мочевого пузыря или прямой кишки и/или выходит за пределы малого таза. Стадия по FIGO 4а.
- M1 — Отдалённые метастазы. Стадия по FIGO 4b.
FIGO – the International Federation of Gynecology and Obstetrics.
Этиология
В настоящее время выявлены факторы, которые повышают риск заболевания раком шейки матки. К ним относятся[1][6]:
- Раннее начало половой жизни (до 16 лет).
- Частая смена сексуальных партнёров (более 2—3 в год).
- Курение.
- Инфицирование вирусом папилломы человека.
В большинстве случаев фактором риска развития рака является вирус папилломы человека 16-го и 18-го серотипов. Вирусы данных серотипов ответственны за 65—75 % случаев возникновения рака шейки матки. Заражение вирусом папилломы человека происходит преимущественно половым путём, а барьерные средства контрацепции зачастую обладают недостаточной эффективностью в защите от инфицирования ВПЧ.[6]
Несмотря на то, что инфицирование при половом контакте с носителем ВПЧ достигает 75 %, в 90 % случаев вирус достаточно быстро уничтожается иммунной системой, и только если вирусу удаётся преодолеть иммунную защиту, развивается персистирующее течение заболевания, сопровождающееся изменениями в эпителии шейки матки.[6]
Следует отметить, что исследования ВОЗ показали, что женщина, имевшая в течение жизни более 10 половых партнёров, имеет в 3 раза больший риск заболеть раком шейки матки. Также следует отметить, что у женщин, страдающих ВПЧ, их постоянные половые партнёры в 5 раз чаще, чем мужчины в прочей популяции, имели более 20 половых партнёров.[6]
Патогенез
Злокачественные новообразования возникают в результате повреждения механизмов апоптоза. В случае рака шейки матки антионкогенную активность проявляют гены p53 Rb. При персистирующей инфекции вирусом папилломы человека эти антионкогены блокируются белками, производимыми вирусными генами Е5 и Е6. Белок, синтезируемый геном Е6, инактивирует опухолевый супрессор, запускающий механизм клеточной смерти бесконтрольно пролиферирующих клеток. Кроме того, данный белок активирует теломеразу, что увеличивает шансы возникновения бессмертных клонов клеток и, как следствие, развития злокачественных образований. Следует отметить, что белок, синтезируемый геном Е6, не активен в отсутствие белка, синтезируемого геном Е7. Белок, вырабатываемый геном Е7, способен и самостоятельно вызывать опухолевую трансформацию клеток, но его действие значительно усиливается в присутствии белка, синтезируемого Е6. Блок Е7 блокирует циклин-зависимые киназы р21 и р26, что позволяет повреждённой клетке начать делиться. Таким образом мы видим, что вирус папилломы человека в результате своей жизнедеятельности повреждает противоопухолевую защиту клетки, значительно увеличивая риск развития злокачественных новообразований.[6][7]
Клиническая картина
Симптоматика на ранних стадиях может отсутствовать или проявляться в виде трудно дифференцируемого дискомфорта. На более поздних стадиях развития заболевания могут возникать следующие клинические признаки.[8]
- Патологические вагинальные кровотечения.
- Кровотечения после полового акта, спринцевания или вагинального осмотра гинекологом.
- Изменения характера и длительности менструации.
- Возникновение кровянистого отделяемого во влагалище после наступления менопаузы.
- Боль в области малого таза.
- Боль во время полового акта.
Все приведённые выше клинические признаки неспецифичны. Также развитие рака шейки матки может сопровождаться системными эффектами, например:
Отсутствие характерных клинических признаков и отсутствие жалоб в дебюте заболевания значительно затрудняют раннюю диагностику и при отсутствии регулярного гинекологического осмотра приводят к поздней диагностике заболевания, значительно ухудшающей прогноз выздоровления.
Диагностика
В связи со стёртостью клинических проявлений и отсутствием специфической клиники наиболее эффективным методом диагностики являются регулярные гинекологические осмотры, призванные выявить ранние стадии злокачественных новообразований.[1]
Скрининговым методом, позволяющим выявить рак шейки матки на разных стадиях развития, является цитологическое исследование. Данные сравнительного анализа показывают, что оптимальным по эффективности и трудозатратам является обследование раз в 2—3 года. Ежегодные обследования увеличивают трудозатраты в 3 раза, а частота обнаружения новообразований возрастает только на 2 %. Следует отметить, что достаточно часто в поздней диагностике виноваты сами больные, когда они, при обнаружении у себя бессимптомно текущего рака шейки матки, своевременно не начинают лечение и обращаются за медицинской помощью на поздних стадиях, когда эффективность терапии в разы ниже, чем на ранних этапах.[1]
Основным методом диагностики является кольпоскопия, которая по мере необходимости расширяется различными дополнительными манипуляциями. Так, в случае скрининга проводится цитологическое исследование мазков отпечатков. Также шейка матки может обрабатываться уксусной кислотой для выявления плоских кондиллом, которые будут проявляется как пятна другого цвета, на поверхности нормальной шейки. В случае подозрения на наличие атипичных клеток проводится кольпоскопия с биопсией. Признаком предраковых состояний является обнаруживаемый при цитологическом обследовании пойкилоцитоз. Следует отметить, что предраковые состояния не всегда приводят к развитию злокачественных новообразований, но их наличие является плохим прогностическим признаком в отношении риска возникновения рака шейки матки.[1]
Лечение
Лечение рака шейки матки комплексное, оно может сочетать в себе хирургическое лечение, лучевую терапию и химиотерапию.[9] Ранее считалось, что наиболее эффективным при лечении рака шейки матки является сочетание хирургического и лучевого методов лечения. Ряд исследований, проведённых в 1999—2000 годах, показал, что добавление химиотерапии значительно повышает эффективность лучевой терапии.[10]
Комбинированное лечение показано во всех случаях наличия регионарного метастазирования.
Хирургическое лечение
При распространённых инвазивных формах рака шейки матки применяется расширенная гистероэктомия по методу Вертгейма—Мейгса, суть которой заключается в одномоментном иссечении тазовой клетчатки с заключёнными в ней лимфоузлами, удалении матки с придатками и не менее трети влагалищной трубки. В некоторых случаях производится экзентерация таза, но в настоящее время данный метод применяется относительно редко в связи с его высокой травматичностью для больного и эффективностью, незначительно превышающей гистероэктомию.[9]
Лучевая терапия
Лучевая терапия является ведущим методом лечения рака шейки матки и зачастую, в сочетании с химиотерапией, единственно возможным на 3—4 стадии в связи с невозможностью хирургического вмешательства. Применяется дистанционная гамма-терапия. Разовая доза, подаваемая на область воздействия, составляет 2 грей. Как правило, дистанционная гамма терапия сочетается с внутриполостным облучением шейки матки.[9]
Химиотерапия
В сочетании с лучевой терапией проводится полихимиотерапия несколькими цитостатическими препаратами. С одной стороны, эта терапия позволяет повысить эффективность лучевой терапии, добиться снижения дозы облучения и снизить шансы возникновения радиоиндуцированных опухолей. С другой стороны, сочетание химио- и лучевой терапии плохо переносится больными и приводит к усилению побочных эффектов. Ряд специалистов придерживаются мнения, что курсовая полихимиотерапия в сочетании с лучевой терапией малоэффективна и даже опасна.
Однако многие специалисты сходятся во мнении, что регионарная внутриартериальная химиотерапия цитостатиками желательна при проведении лучевой терапии, исследования показали повышение выживаемости больных, получавших подобное сочетание.[9]
Считается доказанной эффективность введения на фоне проведения лучевой терапии препаратов платины (цисплатин).[9]
Иммунотерапия
В настоящее время активно изучается вопрос сохранения иммунитета при лучевой и химиотерапии с целью обеспечения возможности организму задействовать и свои противоопухолевые механизмы. Считается, что относительно эффективным является введение интерферонов; относительно дозировки препаратов в научной среде идут активные дискуссии, и единого консенсусного мнения в настоящее время не существует.[9]
Профилактика
Важную роль в профилактике рака шейки матки играет профилактика заражения вирусом папилломы человека. В настоящее время в России рекомендована вакцинопрофилактика папилломавирусной инфекции девочкам 13—15 лет. В некоторых странах прививают и мальчиков препубертатного возраста, с целью сократить циркуляцию вируса папилломы. Вакцинация проводится вакцинами Гардасил с интервалом 0-2-6 или Церварикс с интервалом 0-1-6.
Прогноз
Прогноз условно благоприятен и зависит от стадии, на которой было выявлено заболевание. В России относительная пятилетняя выживаемость на ранних стадиях составляет около 92 %. Общая выживаемость, включающая и поздние стадии заболевания, составляет 72 %.[3] По данным других источников, 5-летняя выживаемость при первой стадии составляет 78,1 %, при второй — 57 %, при третьей — 31 %, при четвёртой — 7,8 %.[4]
Примечания
- ↑ 1 2 3 4 5 6 (PDF) Новик, В. И. Эпидемиология рака шейки матки. Факторы риска скрининг (недоступная ссылка — история). «Практическая онкология». Т. 3, № 2 (2002). Проверено 8 июня 2009. Архивировано 1 марта 2004 года.
- ↑ Предрак и рак шейки матки. ЦИР. Проверено 8 июня 2009. Архивировано 2 апреля 2012 года.
- ↑ 1 2 3 www.medmax.ru Рак шейки матки, симптомы, лечение
- ↑ 1 2 Черкасский областной онкологический диспансер. Этиология и патогенез рака шейки матки.
- ↑ Рак шейки матки. Классификация
- ↑ 1 2 3 4 5 (PDF) Гурцевич, В. Э. Рак шейки матки: Причины, следствия, профилактика (недоступная ссылка — история). Журнал «СПИД, рак и общественное здоровье». Т. 11, № 1 (2007). Проверено 8 июня 2009.
- ↑ Хансон, К. П. Современные представление о канцерогенезе рака шейки матки. (недоступная ссылка — история). Журнал «Практическая онкология» том 3 № 3 (2002). Проверено 9 июня 2009. Архивировано 8 ноября 2005 года.
- ↑ Симптомы рака шейки матки
- ↑ 1 2 3 4 5 6 (PDF) Максимов, С. Я. Комбинированное лечение рака шейки матки (недоступная ссылка — история). «Практическая онкология». Т. 3, № 3 (2002). Проверено 8 июня 2009. Архивировано 8 ноября 2005 года.
- ↑ ASCO 2001: рак яичников и шейки матки. Тюляндин С. А. Российский онкологический научный центр им. Н. Н. Блохина РАМН, Москва
Ссылки
Литература
- Шайн А. А. Онкология. Учебник для студентов медицинских вузов. — Медицинское информационное агентство, 2004. — 544 с.
- Ганцев Ш. X. Онкология. Учебник для студентов медицинских вузов. — 2-е издание, исправленное и дополненное. — Москва: Медицинское информационное агентство, 2006. — 488 с. — ISBN 5-89481-418-9.
Рак ше́йки ма́тки — злокачественное новообразование, возникающее в области шейки матки. Гистологически различают две его основные разновидности: аденокарцинома и плоскоклеточный рак. В настоящее время считается доказанной связь заболеваемости вирусом папилломы человека и риском развития рака шейки матки.[1]
Значимость и распространённость
Исследования вопроса заболеваемости раком шейки матки проводились ещё в XIX веке, и полученные результаты показывали связь активности половой жизни и частоты встречаемости рака. Современные исследования подтверждают эти данные, наблюдается связь между частотой смены половых партнёров и риском заболевания раком шейки матки.[2] В России в 2002 году было зарегистрировано 12 285 случаев заболевания раком шейки матки.[3] Данное заболевание наиболее часто встречается у женщин среднего возраста (35—55 лет), в 20 % случаев обнаруживается в возрасте старше 65 лет, в молодом возрасте встречается относительно редко. Следует отметить, что заболеваемость раком шейки матки значительно превышает заболеваемость другими опухолями женской половой системы.[3] В начале XXI века отмечается увеличение больных раком шейки матки на поздних стадиях: доля рака IV стадии, по разным данным, составляет 37,1 % — 47,3 %.[1][4]
Классификация
При классификации рака шейки матки используется стандартная TNM-классификация злокачественных новообразований.[5]
- Тх — недостаточно данных для оценки опухоли.
- Т0 — первичная опухоль не определяется.
- Tis — карцинома преинвазивная. Стадия по FIGO 0
- Т1 — Рак, ограниченный шейкой матки (без учёта тела матки). Стадия по FIGO 1
- Т1а — Инвазивная опухоль, обнаруживается только микроскопически. Стадия по FIGO 1а
- Т1а1 — Инвазия в строму до 3,0 мм в глубину и до 7,0 мм поверхности. Стадия по FIGO 1а 1
- Т1а2 — Инвазия в строму до 5,0 мм в глубину и до 7,0 мм по поверхности. Стадия по FIGO 1а 2
- T1b — Клинически определяемый очаг поражения, ограниченный шейкой матки или микроскопически определяемое поражение большего размера, чем Т1А/1A2. Стадия по FIGO 1b
- T1b1 — Клинически определяемый очаг поражения до 4,0 см в наибольшем измерении. Стадия по FIGO 1b1
- T1b2 — Клинически определяемый очаг поражения более 4,0 см. Стадия по FIGO 1b1
- Т2 — Опухоль шейки матки с распространением за пределы матки, но без прорастания стенки таза или нижней трети влагалища. Стадия по FIGO 2
- T2a — Без инвазии в параметрий. Стадия по FIGO 2a
- T2b — С инвазией в параметрий. Стадия по FIGO 2b.
- Т3 — Рак шейки матки с распространением на стенку таза, поражение нижней трети влагалища, нарушение функции почки. Стадия по FIGO 3.
- Т3а — Опухоль поражает нижнюю треть влагалища, но не распространяется на стенку таза, и не повреждает почки. Стадия по FIGO 3a.
- T3b — Опухоль распространяется на стенку таза и/или приводит к гидронефрозу и нефункционирующей почке. Стадия по FIGO 3b.
- Т4 — Опухоль распространяется на слизистую оболочку мочевого пузыря или прямой кишки и/или выходит за пределы малого таза. Стадия по FIGO 4а.
- M1 — Отдалённые метастазы. Стадия по FIGO 4b.
FIGO – the International Federation of Gynecology and Obstetrics.
Этиология
В настоящее время выявлены факторы, которые повышают риск заболевания раком шейки матки. К ним относятся[1][6]:
- Раннее начало половой жизни (до 16 лет).
- Частая смена сексуальных партнёров (более 2—3 в год).
- Курение.
- Инфицирование вирусом папилломы человека.
В большинстве случаев фактором риска развития рака является вирус папилломы человека 16-го и 18-го серотипов. Вирусы данных серотипов ответственны за 65—75 % случаев возникновения рака шейки матки. Заражение вирусом папилломы человека происходит преимущественно половым путём, а барьерные средства контрацепции зачастую обладают недостаточной эффективностью в защите от инфицирования ВПЧ.[6]
Несмотря на то, что инфицирование при половом контакте с носителем ВПЧ достигает 75 %, в 90 % случаев вирус достаточно быстро уничтожается иммунной системой, и только если вирусу удаётся преодолеть иммунную защиту, развивается персистирующее течение заболевания, сопровождающееся изменениями в эпителии шейки матки.[6]
Следует отметить, что исследования ВОЗ показали, что женщина, имевшая в течение жизни более 10 половых партнёров, имеет в 3 раза больший риск заболеть раком шейки матки. Также следует отметить, что у женщин, страдающих ВПЧ, их постоянные половые партнёры в 5 раз чаще, чем мужчины в прочей популяции, имели более 20 половых партнёров.[6]
Патогенез
Злокачественные новообразования возникают в результате повреждения механизмов апоптоза. В случае рака шейки матки антионкогенную активность проявляют гены p53 Rb. При персистирующей инфекции вирусом папилломы человека эти антионкогены блокируются белками, производимыми вирусными генами Е5 и Е6. Белок, синтезируемый геном Е6, инактивирует опухолевый супрессор, запускающий механизм клеточной смерти бесконтрольно пролиферирующих клеток. Кроме того, данный белок активирует теломеразу, что увеличивает шансы возникновения бессмертных клонов клеток и, как следствие, развития злокачественных образований. Следует отметить, что белок, синтезируемый геном Е6, не активен в отсутствие белка, синтезируемого геном Е7. Белок, вырабатываемый геном Е7, способен и самостоятельно вызывать опухолевую трансформацию клеток, но его действие значительно усиливается в присутствии белка, синтезируемого Е6. Блок Е7 блокирует циклин-зависимые киназы р21 и р26, что позволяет повреждённой клетке начать делиться. Таким образом мы видим, что вирус папилломы человека в результате своей жизнедеятельности повреждает противоопухолевую защиту клетки, значительно увеличивая риск развития злокачественных новообразований.[6][7]
Клиническая картина
Симптоматика на ранних стадиях может отсутствовать или проявляться в виде трудно дифференцируемого дискомфорта. На более поздних стадиях развития заболевания могут возникать следующие клинические признаки.[8]
- Патологические вагинальные кровотечения.
- Кровотечения после полового акта, спринцевания или вагинального осмотра гинекологом.
- Изменения характера и длительности менструации.
- Возникновение кровянистого отделяемого во влагалище после наступления менопаузы.
- Боль в области малого таза.
- Боль во время полового акта.
Все приведённые выше клинические признаки неспецифичны. Также развитие рака шейки матки может сопровождаться системными эффектами, например:
Отсутствие характерных клинических признаков и отсутствие жалоб в дебюте заболевания значительно затрудняют раннюю диагностику и при отсутствии регулярного гинекологического осмотра приводят к поздней диагностике заболевания, значительно ухудшающей прогноз выздоровления.
Диагностика
В связи со стёртостью клинических проявлений и отсутствием специфической клиники наиболее эффективным методом диагностики являются регулярные гинекологические осмотры, призванные выявить ранние стадии злокачественных новообразований.[1]
Скрининговым методом, позволяющим выявить рак шейки матки на разных стадиях развития, является цитологическое исследование. Данные сравнительного анализа показывают, что оптимальным по эффективности и трудозатратам является обследование раз в 2—3 года. Ежегодные обследования увеличивают трудозатраты в 3 раза, а частота обнаружения новообразований возрастает только на 2 %. Следует отметить, что достаточно часто в поздней диагностике виноваты сами больные, когда они, при обнаружении у себя бессимптомно текущего рака шейки матки, своевременно не начинают лечение и обращаются за медицинской помощью на поздних стадиях, когда эффективность терапии в разы ниже, чем на ранних этапах.[1]
Основным методом диагностики является кольпоскопия, которая по мере необходимости расширяется различными дополнительными манипуляциями. Так, в случае скрининга проводится цитологическое исследование мазков отпечатков. Также шейка матки может обрабатываться уксусной кислотой для выявления плоских кондиллом, которые будут проявляется как пятна другого цвета, на поверхности нормальной шейки. В случае подозрения на наличие атипичных клеток проводится кольпоскопия с биопсией. Признаком предраковых состояний является обнаруживаемый при цитологическом обследовании пойкилоцитоз. Следует отметить, что предраковые состояния не всегда приводят к развитию злокачественных новообразований, но их наличие является плохим прогностическим признаком в отношении риска возникновения рака шейки матки.[1]
Лечение
Лечение рака шейки матки комплексное, оно может сочетать в себе хирургическое лечение, лучевую терапию и химиотерапию.[9] Ранее считалось, что наиболее эффективным при лечении рака шейки матки является сочетание хирургического и лучевого методов лечения. Ряд исследований, проведённых в 1999—2000 годах, показал, что добавление химиотерапии значительно повышает эффективность лучевой терапии.[10]
Комбинированное лечение показано во всех случаях наличия регионарного метастазирования.
Хирургическое лечение
При распространённых инвазивных формах рака шейки матки применяется расширенная гистероэктомия по методу Вертгейма—Мейгса, суть которой заключается в одномоментном иссечении тазовой клетчатки с заключёнными в ней лимфоузлами, удалении матки с придатками и не менее трети влагалищной трубки. В некоторых случаях производится экзентерация таза, но в настоящее время данный метод применяется относительно редко в связи с его высокой травматичностью для больного и эффективностью, незначительно превышающей гистероэктомию.[9]
Лучевая терапия
Лучевая терапия является ведущим методом лечения рака шейки матки и зачастую, в сочетании с химиотерапией, единственно возможным на 3—4 стадии в связи с невозможностью хирургического вмешательства. Применяется дистанционная гамма-терапия. Разовая доза, подаваемая на область воздействия, составляет 2 грей. Как правило, дистанционная гамма терапия сочетается с внутриполостным облучением шейки матки.[9]
Химиотерапия
В сочетании с лучевой терапией проводится полихимиотерапия несколькими цитостатическими препаратами. С одной стороны, эта терапия позволяет повысить эффективность лучевой терапии, добиться снижения дозы облучения и снизить шансы возникновения радиоиндуцированных опухолей. С другой стороны, сочетание химио- и лучевой терапии плохо переносится больными и приводит к усилению побочных эффектов. Ряд специалистов придерживаются мнения, что курсовая полихимиотерапия в сочетании с лучевой терапией малоэффективна и даже опасна.
Однако многие специалисты сходятся во мнении, что регионарная внутриартериальная химиотерапия цитостатиками желательна при проведении лучевой терапии, исследования показали повышение выживаемости больных, получавших подобное сочетание.[9]
Считается доказанной эффективность введения на фоне проведения лучевой терапии препаратов платины (цисплатин).[9]
Иммунотерапия
В настоящее время активно изучается вопрос сохранения иммунитета при лучевой и химиотерапии с целью обеспечения возможности организму задействовать и свои противоопухолевые механизмы. Считается, что относительно эффективным является введение интерферонов; относительно дозировки препаратов в научной среде идут активные дискуссии, и единого консенсусного мнения в настоящее время не существует.[9]
Профилактика
Важную роль в профилактике рака шейки матки играет профилактика заражения вирусом папилломы человека. В настоящее время в России рекомендована вакцинопрофилактика папилломавирусной инфекции девочкам 13—15 лет. В некоторых странах прививают и мальчиков препубертатного возраста, с целью сократить циркуляцию вируса папилломы. Вакцинация проводится вакцинами Гардасил с интервалом 0-2-6 или Церварикс с интервалом 0-1-6.
Прогноз
Прогноз условно благоприятен и зависит от стадии, на которой было выявлено заболевание. В России относительная пятилетняя выживаемость на ранних стадиях составляет около 92 %. Общая выживаемость, включающая и поздние стадии заболевания, составляет 72 %.[3] По данным других источников, 5-летняя выживаемость при первой стадии составляет 78,1 %, при второй — 57 %, при третьей — 31 %, при четвёртой — 7,8 %.[4]
Примечания
- ↑ 1 2 3 4 5 6 (PDF) Новик, В. И. Эпидемиология рака шейки матки. Факторы риска скрининг (недоступная ссылка — история). «Практическая онкология». Т. 3, № 2 (2002). Проверено 8 июня 2009. Архивировано 1 марта 2004 года.
- ↑ Предрак и рак шейки матки. ЦИР. Проверено 8 июня 2009. Архивировано 2 апреля 2012 года.
- ↑ 1 2 3 www.medmax.ru Рак шейки матки, симптомы, лечение
- ↑ 1 2 Черкасский областной онкологический диспансер. Этиология и патогенез рака шейки матки.
- ↑ Рак шейки матки. Классификация
- ↑ 1 2 3 4 5 (PDF) Гурцевич, В. Э. Рак шейки матки: Причины, следствия, профилактика (недоступная ссылка — история). Журнал «СПИД, рак и общественное здоровье». Т. 11, № 1 (2007). Проверено 8 июня 2009.
- ↑ Хансон, К. П. Современные представление о канцерогенезе рака шейки матки. (недоступная ссылка — история). Журнал «Практическая онкология» том 3 № 3 (2002). Проверено 9 июня 2009. Архивировано 8 ноября 2005 года.
- ↑ Симптомы рака шейки матки
- ↑ 1 2 3 4 5 6 (PDF) Максимов, С. Я. Комбинированное лечение рака шейки матки (недоступная ссылка — история). «Практическая онкология». Т. 3, № 3 (2002). Проверено 8 июня 2009. Архивировано 8 ноября 2005 года.
- ↑ ASCO 2001: рак яичников и шейки матки. Тюляндин С. А. Российский онкологический научный центр им. Н. Н. Блохина РАМН, Москва
Ссылки
Литература
- Шайн А. А. Онкология. Учебник для студентов медицинских вузов. — Медицинское информационное агентство, 2004. — 544 с.
- Ганцев Ш. X. Онкология. Учебник для студентов медицинских вузов. — 2-е издание, исправленное и дополненное. — Москва: Медицинское информационное агентство, 2006. — 488 с. — ISBN 5-89481-418-9.
Рак ше́йки ма́тки — злокачественное новообразование, возникающее в области шейки матки. Гистологически различают две его основные разновидности: аденокарцинома и плоскоклеточный рак. В настоящее время считается доказанной связь заболеваемости вирусом папилломы человека и риском развития рака шейки матки.[1]
Значимость и распространённость
Исследования вопроса заболеваемости раком шейки матки проводились ещё в XIX веке, и полученные результаты показывали связь активности половой жизни и частоты встречаемости рака. Современные исследования подтверждают эти данные, наблюдается связь между частотой смены половых партнёров и риском заболевания раком шейки матки.[2] В России в 2002 году было зарегистрировано 12 285 случаев заболевания раком шейки матки.[3] Данное заболевание наиболее часто встречается у женщин среднего возраста (35—55 лет), в 20 % случаев обнаруживается в возрасте старше 65 лет, в молодом возрасте встречается относительно редко. Следует отметить, что заболеваемость раком шейки матки значительно превышает заболеваемость другими опухолями женской половой системы.[3] В начале XXI века отмечается увеличение больных раком шейки матки на поздних стадиях: доля рака IV стадии, по разным данным, составляет 37,1 % — 47,3 %.[1][4]
Классификация
При классификации рака шейки матки используется стандартная TNM-классификация злокачественных новообразований.[5]
- Тх — недостаточно данных для оценки опухоли.
- Т0 — первичная опухоль не определяется.
- Tis — карцинома преинвазивная. Стадия по FIGO 0
- Т1 — Рак, ограниченный шейкой матки (без учёта тела матки). Стадия по FIGO 1
- Т1а — Инвазивная опухоль, обнаруживается только микроскопически. Стадия по FIGO 1а
- Т1а1 — Инвазия в строму до 3,0 мм в глубину и до 7,0 мм поверхности. Стадия по FIGO 1а 1
- Т1а2 — Инвазия в строму до 5,0 мм в глубину и до 7,0 мм по поверхности. Стадия по FIGO 1а 2
- T1b — Клинически определяемый очаг поражения, ограниченный шейкой матки или микроскопически определяемое поражение большего размера, чем Т1А/1A2. Стадия по FIGO 1b
- T1b1 — Клинически определяемый очаг поражения до 4,0 см в наибольшем измерении. Стадия по FIGO 1b1
- T1b2 — Клинически определяемый очаг поражения более 4,0 см. Стадия по FIGO 1b1
- Т2 — Опухоль шейки матки с распространением за пределы матки, но без прорастания стенки таза или нижней трети влагалища. Стадия по FIGO 2
- T2a — Без инвазии в параметрий. Стадия по FIGO 2a
- T2b — С инвазией в параметрий. Стадия по FIGO 2b.
- Т3 — Рак шейки матки с распространением на стенку таза, поражение нижней трети влагалища, нарушение функции почки. Стадия по FIGO 3.
- Т3а — Опухоль поражает нижнюю треть влагалища, но не распространяется на стенку таза, и не повреждает почки. Стадия по FIGO 3a.
- T3b — Опухоль распространяется на стенку таза и/или приводит к гидронефрозу и нефункционирующей почке. Стадия по FIGO 3b.
- Т4 — Опухоль распространяется на слизистую оболочку мочевого пузыря или прямой кишки и/или выходит за пределы малого таза. Стадия по FIGO 4а.
- M1 — Отдалённые метастазы. Стадия по FIGO 4b.
FIGO – the International Federation of Gynecology and Obstetrics.
Этиология
В настоящее время выявлены факторы, которые повышают риск заболевания раком шейки матки. К ним относятся[1][6]:
- Раннее начало половой жизни (до 16 лет).
- Частая смена сексуальных партнёров (более 2—3 в год).
- Курение.
- Инфицирование вирусом папилломы человека.
В большинстве случаев фактором риска развития рака является вирус папилломы человека 16-го и 18-го серотипов. Вирусы данных серотипов ответственны за 65—75 % случаев возникновения рака шейки матки. Заражение вирусом папилломы человека происходит преимущественно половым путём, а барьерные средства контрацепции зачастую обладают недостаточной эффективностью в защите от инфицирования ВПЧ.[6]
Несмотря на то, что инфицирование при половом контакте с носителем ВПЧ достигает 75 %, в 90 % случаев вирус достаточно быстро уничтожается иммунной системой, и только если вирусу удаётся преодолеть иммунную защиту, развивается персистирующее течение заболевания, сопровождающееся изменениями в эпителии шейки матки.[6]
Следует отметить, что исследования ВОЗ показали, что женщина, имевшая в течение жизни более 10 половых партнёров, имеет в 3 раза больший риск заболеть раком шейки матки. Также следует отметить, что у женщин, страдающих ВПЧ, их постоянные половые партнёры в 5 раз чаще, чем мужчины в прочей популяции, имели более 20 половых партнёров.[6]
Патогенез
Злокачественные новообразования возникают в результате повреждения механизмов апоптоза. В случае рака шейки матки антионкогенную активность проявляют гены p53 Rb. При персистирующей инфекции вирусом папилломы человека эти антионкогены блокируются белками, производимыми вирусными генами Е5 и Е6. Белок, синтезируемый геном Е6, инактивирует опухолевый супрессор, запускающий механизм клеточной смерти бесконтрольно пролиферирующих клеток. Кроме того, данный белок активирует теломеразу, что увеличивает шансы возникновения бессмертных клонов клеток и, как следствие, развития злокачественных образований. Следует отметить, что белок, синтезируемый геном Е6, не активен в отсутствие белка, синтезируемого геном Е7. Белок, вырабатываемый геном Е7, способен и самостоятельно вызывать опухолевую трансформацию клеток, но его действие значительно усиливается в присутствии белка, синтезируемого Е6. Блок Е7 блокирует циклин-зависимые киназы р21 и р26, что позволяет повреждённой клетке начать делиться. Таким образом мы видим, что вирус папилломы человека в результате своей жизнедеятельности повреждает противоопухолевую защиту клетки, значительно увеличивая риск развития злокачественных новообразований.[6][7]
Клиническая картина
Симптоматика на ранних стадиях может отсутствовать или проявляться в виде трудно дифференцируемого дискомфорта. На более поздних стадиях развития заболевания могут возникать следующие клинические признаки.[8]
- Патологические вагинальные кровотечения.
- Кровотечения после полового акта, спринцевания или вагинального осмотра гинекологом.
- Изменения характера и длительности менструации.
- Возникновение кровянистого отделяемого во влагалище после наступления менопаузы.
- Боль в области малого таза.
- Боль во время полового акта.
Все приведённые выше клинические признаки неспецифичны. Также развитие рака шейки матки может сопровождаться системными эффектами, например:
Отсутствие характерных клинических признаков и отсутствие жалоб в дебюте заболевания значительно затрудняют раннюю диагностику и при отсутствии регулярного гинекологического осмотра приводят к поздней диагностике заболевания, значительно ухудшающей прогноз выздоровления.
Диагностика
В связи со стёртостью клинических проявлений и отсутствием специфической клиники наиболее эффективным методом диагностики являются регулярные гинекологические осмотры, призванные выявить ранние стадии злокачественных новообразований.[1]
Скрининговым методом, позволяющим выявить рак шейки матки на разных стадиях развития, является цитологическое исследование. Данные сравнительного анализа показывают, что оптимальным по эффективности и трудозатратам является обследование раз в 2—3 года. Ежегодные обследования увеличивают трудозатраты в 3 раза, а частота обнаружения новообразований возрастает только на 2 %. Следует отметить, что достаточно часто в поздней диагностике виноваты сами больные, когда они, при обнаружении у себя бессимптомно текущего рака шейки матки, своевременно не начинают лечение и обращаются за медицинской помощью на поздних стадиях, когда эффективность терапии в разы ниже, чем на ранних этапах.[1]
Основным методом диагностики является кольпоскопия, которая по мере необходимости расширяется различными дополнительными манипуляциями. Так, в случае скрининга проводится цитологическое исследование мазков отпечатков. Также шейка матки может обрабатываться уксусной кислотой для выявления плоских кондиллом, которые будут проявляется как пятна другого цвета, на поверхности нормальной шейки. В случае подозрения на наличие атипичных клеток проводится кольпоскопия с биопсией. Признаком предраковых состояний является обнаруживаемый при цитологическом обследовании пойкилоцитоз. Следует отметить, что предраковые состояния не всегда приводят к развитию злокачественных новообразований, но их наличие является плохим прогностическим признаком в отношении риска возникновения рака шейки матки.[1]
Лечение
Лечение рака шейки матки комплексное, оно может сочетать в себе хирургическое лечение, лучевую терапию и химиотерапию.[9] Ранее считалось, что наиболее эффективным при лечении рака шейки матки является сочетание хирургического и лучевого методов лечения. Ряд исследований, проведённых в 1999—2000 годах, показал, что добавление химиотерапии значительно повышает эффективность лучевой терапии.[10]
Комбинированное лечение показано во всех случаях наличия регионарного метастазирования.
Хирургическое лечение
При распространённых инвазивных формах рака шейки матки применяется расширенная гистероэктомия по методу Вертгейма—Мейгса, суть которой заключается в одномоментном иссечении тазовой клетчатки с заключёнными в ней лимфоузлами, удалении матки с придатками и не менее трети влагалищной трубки. В некоторых случаях производится экзентерация таза, но в настоящее время данный метод применяется относительно редко в связи с его высокой травматичностью для больного и эффективностью, незначительно превышающей гистероэктомию.[9]
Лучевая терапия
Лучевая терапия является ведущим методом лечения рака шейки матки и зачастую, в сочетании с химиотерапией, единственно возможным на 3—4 стадии в связи с невозможностью хирургического вмешательства. Применяется дистанционная гамма-терапия. Разовая доза, подаваемая на область воздействия, составляет 2 грей. Как правило, дистанционная гамма терапия сочетается с внутриполостным облучением шейки матки.[9]
Химиотерапия
В сочетании с лучевой терапией проводится полихимиотерапия несколькими цитостатическими препаратами. С одной стороны, эта терапия позволяет повысить эффективность лучевой терапии, добиться снижения дозы облучения и снизить шансы возникновения радиоиндуцированных опухолей. С другой стороны, сочетание химио- и лучевой терапии плохо переносится больными и приводит к усилению побочных эффектов. Ряд специалистов придерживаются мнения, что курсовая полихимиотерапия в сочетании с лучевой терапией малоэффективна и даже опасна.
Однако многие специалисты сходятся во мнении, что регионарная внутриартериальная химиотерапия цитостатиками желательна при проведении лучевой терапии, исследования показали повышение выживаемости больных, получавших подобное сочетание.[9]
Считается доказанной эффективность введения на фоне проведения лучевой терапии препаратов платины (цисплатин).[9]
Иммунотерапия
В настоящее время активно изучается вопрос сохранения иммунитета при лучевой и химиотерапии с целью обеспечения возможности организму задействовать и свои противоопухолевые механизмы. Считается, что относительно эффективным является введение интерферонов; относительно дозировки препаратов в научной среде идут активные дискуссии, и единого консенсусного мнения в настоящее время не существует.[9]
Профилактика
Важную роль в профилактике рака шейки матки играет профилактика заражения вирусом папилломы человека. В настоящее время в России рекомендована вакцинопрофилактика папилломавирусной инфекции девочкам 13—15 лет. В некоторых странах прививают и мальчиков препубертатного возраста, с целью сократить циркуляцию вируса папилломы. Вакцинация проводится вакцинами Гардасил с интервалом 0-2-6 или Церварикс с интервалом 0-1-6.
Прогноз
Прогноз условно благоприятен и зависит от стадии, на которой было выявлено заболевание. В России относительная пятилетняя выживаемость на ранних стадиях составляет около 92 %. Общая выживаемость, включающая и поздние стадии заболевания, составляет 72 %.[3] По данным других источников, 5-летняя выживаемость при первой стадии составляет 78,1 %, при второй — 57 %, при третьей — 31 %, при четвёртой — 7,8 %.[4]
Примечания
- ↑ 1 2 3 4 5 6 (PDF) Новик, В. И. Эпидемиология рака шейки матки. Факторы риска скрининг (недоступная ссылка — история). «Практическая онкология». Т. 3, № 2 (2002). Проверено 8 июня 2009. Архивировано 1 марта 2004 года.
- ↑ Предрак и рак шейки матки. ЦИР. Проверено 8 июня 2009. Архивировано 2 апреля 2012 года.
- ↑ 1 2 3 www.medmax.ru Рак шейки матки, симптомы, лечение
- ↑ 1 2 Черкасский областной онкологический диспансер. Этиология и патогенез рака шейки матки.
- ↑ Рак шейки матки. Классификация
- ↑ 1 2 3 4 5 (PDF) Гурцевич, В. Э. Рак шейки матки: Причины, следствия, профилактика (недоступная ссылка — история). Журнал «СПИД, рак и общественное здоровье». Т. 11, № 1 (2007). Проверено 8 июня 2009.
- ↑ Хансон, К. П. Современные представление о канцерогенезе рака шейки матки. (недоступная ссылка — история). Журнал «Практическая онкология» том 3 № 3 (2002). Проверено 9 июня 2009. Архивировано 8 ноября 2005 года.
- ↑ Симптомы рака шейки матки
- ↑ 1 2 3 4 5 6 (PDF) Максимов, С. Я. Комбинированное лечение рака шейки матки (недоступная ссылка — история). «Практическая онкология». Т. 3, № 3 (2002). Проверено 8 июня 2009. Архивировано 8 ноября 2005 года.
- ↑ ASCO 2001: рак яичников и шейки матки. Тюляндин С. А. Российский онкологический научный центр им. Н. Н. Блохина РАМН, Москва
Ссылки
Литература
- Шайн А. А. Онкология. Учебник для студентов медицинских вузов. — Медицинское информационное агентство, 2004. — 544 с.
- Ганцев Ш. X. Онкология. Учебник для студентов медицинских вузов. — 2-е издание, исправленное и дополненное. — Москва: Медицинское информационное агентство, 2006. — 488 с. — ISBN 5-89481-418-9.
Карцинома — Википедия
Карцинома (др.-греч. καρκίνος — «рак», -ωμα от ὄγκωμα — «опухоль») — вид злокачественной опухоли (рак), развивающейся из клеток эпителиальной ткани различных органов (кожи, слизистых оболочек и многих внутренних органов)[1]. По данным Всемирной организации здравоохранения в 2018 г. от этого заболевания умерли 9,6 млн человек.[2]
Общей характеристикой злокачественных опухолей является их выраженный клеточный атипизм (утрата клетками способности к дифференцировке с нарушением структуры ткани, из которой происходит опухоль), агрессивный рост с поражением как самого органа, так и других близлежащих органов, склонность к метастазированию, то есть к распространению клеток опухоли с током лимфы или крови по всему организму с образованием новых очагов опухолевого роста во многих органах, удалённых от первичного очага. По темпам роста большинство злокачественных опухолей превосходят доброкачественные и, как правило, могут достигать значительных размеров в короткие сроки. Различают также вид злокачественных местнодеструктирующих опухолей, которые растут с образованием инфильтрата в толще ткани, приводя к её разрушению, но, как правило, не метастазируют (базалиома кожи).
Некоторые археологические исследования свидетельствуют о том, что от различных видов рака страдали ещё неандертальцы[3].
Впервые заболевание было описано в древнеегипетском папирусе Эдвина Смита (ок. 1600 г. до н. э.)[4]. В папирусе описываются восемь случаев опухолей или язв молочной железы, которые были удалены при помощи прижигания раковой ткани, а также сообщается, что от этой болезни нет лечения.
Название «карцином» произошло от введённого Гиппократом (460—370 гг. до н. э.) термина «карцинома», обозначавшего злокачественную опухоль с перифокальным воспалением. (Гиппократ назвал опухоль карциномой, потому что она внешне напоминает краба)[5]. Он описал несколько видов рака, а также предложил термин ὄγκος[6].
Римский врач Авл Корнелий Цельс (Aulus Cornelius Celsius) в I в. до н. э. предложил на ранней стадии лечить рак удалением опухоли, а на поздних — не лечить вообще. Он перевёл греческое слово καρκίνος на латынь (cancer — рак). Гален использовал слово ὄγκος для описания всех опухолей, что и дало современный корень слову онкология[7].
Заболеваемость злокачественными опухолями непрерывно растёт. Ежегодно в мире регистрируется порядка 6 миллионов новых случаев заболевания злокачественными опухолями. Наиболее высокая заболеваемость среди мужчин отмечена во Франции (361 на 100 000 населения), среди женщин в Бразилии (283,4 на 100 000). Отчасти это объясняется старением населения. Следует отметить, что большинство опухолей развивается у лиц старше 50 лет, а каждый второй онкологический больной старше 60 лет. Наиболее часто поражаются предстательная железа и лёгкие у мужчин и молочная железа у женщин. Смертность от онкологических заболеваний занимает третье место в мире, вслед за заболеваниями сердечно-сосудистой системы и заболеваниями дыхательной системы (в том числе ХОБЛ).[8]
На данный момент известно большое количество факторов, способных запустить механизмы канцерогенеза (вещества или факторы окружающей среды, обладающие таким свойством, называют канцерогенами).
- Химические канцерогены — к ним относят различные группы полициклических и гетероциклических ароматических углеводородов, ароматические амины, нитрозосоединения, афлатоксины, прочие (винилхлорид, металлы, пластмассы, асбест, многостенные углеродные нанотрубки и др.). Их общей характеристикой является способность реагировать с ДНК клеток, тем самым вызывая их злокачественное перерождение.
- Канцерогены физической природы: различные виды ионизирующего излучения (α-, β-, γ-излучение, рентгеновское излучение, нейтронное излучение, протонное излучение, мюонное излучение, кластерная радиоактивность, потоки ионов, осколки деления, нейтрино высоких энергий[источник не указан 341 день]), ультрафиолетовое излучение.
- Биологические факторы канцерогенеза: различные типы вирусов (герпесоподобный вирус Эпштейна — Барр (лимфома Беркитта), вирус папилломы человека (рак шейки матки), вирусы гепатитов B и C (рак печени)), несущих в своей структуре специфические онкогены, способствующие модификации генетического материала клетки с её последующей малигнизацией.
- Гормональные факторы — некоторые типы гормонов человека (половые гормоны) могут вызвать злокачественное перерождение тканей, чувствительных к действию этих гормонов (рак молочной железы, рак яичка, рак предстательной железы).
- Генетические факторы. Одним из состояний, которые могут спровоцировать развитие заболевания, является пищевод Баррета.
В целом воздействуя на клетку, канцерогены вызывают определённые нарушения её структуры и функции (в особенности ДНК), что называется инициацией. Повреждённая клетка таким образом приобретает выраженный потенциал к малигнизации. Повторное воздействие канцерогена (того же, что вызвал инициацию, или любого другого) приводит к необратимым нарушениям механизмов, контролирующих деление, рост и дифференцировку клеток, в результате которых клетка приобретает ряд способностей, не свойственных нормальным клеткам организма — промоция. В частности, опухолевые клетки приобретают способность к бесконтрольному делению, теряют тканеспецифическую структуру и функциональную активность, изменяют свой антигенный состав и пр.
Рост опухоли (опухолевая прогрессия) характеризуется постепенным снижением дифференцировки и увеличением способности к бесконтрольному делению, а также изменением взаимосвязи опухолевой клетки с организмом, что приводит к образованию метастазов. Метастазирование происходит преимущественно лимфогенным путём (то есть с током лимфы) в регионарные лимфоузлы, или же гематогенным путём (с током крови) с образованием метастазов в различных органах (лёгкие, печень, кости и т. д.).
 Опухолевые клетки карциномы отличаются от нормальных высоким отношением объёма ядра (тёмные области) к объёму всей клетки (светлые)
Опухолевые клетки карциномы отличаются от нормальных высоким отношением объёма ядра (тёмные области) к объёму всей клетки (светлые)
Плоскоклеточный умеренно дифференцированный рак
Строение карциномы в значительной степени зависит от структурно-функциональных особенностей клеток органов, из которых она развилась. Так, из клеток, контактирующих с внешней средой (эпителий кожи, слизистой оболочки рта, пищевода, гортани, прямой кишки), развивается опухоль, состоящая из многослойного плоского эпителия (ороговевающего и неороговевающего), которая носит название плоскоклеточной карциномы (плоскоклеточный рак).
Из эпителия железистых тканей (железы бронхов, молочная железа, простата) развивается опухоль железистой структуры (железистый рак) — аденокарцинома.
По степени дифференцировки выделяют:
- Высокодифференцированные опухоли
- Среднедифференцированные опухоли
- Малодифференцированные опухоли
- Недифференцированные опухоли
Для высокодифференцированных опухолей характерно строение, близкое строению ткани, из которой образовалась данная опухоль. В случае средне- и малодифференцированных опухолей сходство структуры опухоли и исходной ткани снижается, становится стёртым. Иногда клеточный и тканевой атипизм новообразования могут быть настолько выраженными, что определить тканевую принадлежность опухоли практически невозможно (недифференцированные опухоли). Как правило, они характеризуются высокой степенью злокачественности (то есть способностью образовывать метастазы).
В зависимости от преобладания в структуре опухоли стромы (соединительной ткани) или паренхимы (раковых клеток), различают простой рак, в котором строма и паренхима развиты в одинаковой степени, медуллярный рак, в структуре которого преобладает паренхима, и фиброзный рак (скирр), в котором преобладает строма.
Многие раковые клетки (особенно с высоким уровнем дифференцировки) сохраняют за собой функцию исходной ткани. Так, клетки аденокарциномы (рак из железистой ткани) могут продуцировать слизь.
Классификация по системе TNM[править | править код]
Данная классификация использует числовое обозначение различных категорий для обозначения распространения опухоли, а также наличия или отсутствия локальных и отдалённых метастазов.
T — tumor[править | править код]
От латинского слова tumor — опухоль. Описывает и классифицирует основной очаг опухоли.
- T0 — опухоль клинически не определяется.
- Tis — так называемая карцинома «in situ» («рак на месте») — то есть не прорастающая базального слоя эпителия.
- T1—4 — различная степень развития очага. Для каждого из органов существует отдельная расшифровка каждого из индексов.
- Tx — практически не используется. Выставляется только на время, когда обнаружены метастазы, но не выявлен основной очаг.
N — nodulus[править | править код]
От латинского nodulus — узелок. Описывает и характеризует наличие регионарных метастазов, то есть в регионарные лимфатические узлы.
- Nx — выявление регионарных метастазов не проводилось, их наличие не известно.
- N0 — регионарных метастазов не обнаружено при проведении исследования с целью обнаружения метастазов.
- N1—3 — выявлены регионарные метастазы.
M — metastasis[править | править код]
Характеристика наличия отдалённых метастазов, то есть — в отдалённые лимфоузлы, другие органы, ткани (исключая прорастание опухоли).
- Mx — выявление отдалённых метастазов не проводилось, их наличие не известно.
- M0 — отдалённых метастазов не обнаружено при проведении исследования с целью обнаружения метастазов.
- M1 — выявлены отдалённые метастазы.
P, G[править | править код]
Для некоторых органов или систем применяются дополнительные параметры (P или G, в зависимости от системы органов), характеризующие степень дифференцировки и морфологическую близость биоптата к здоровым тканям организма. Клиническая значимость данного критерия определяется тем, что опухоли с высокой степенью дифференцировки лучше поддаются лечению.
- Grade 1 (G1) обозначает высокую степень дифференцировки опухоли (менее агрессивная опухоль с лучшим прогнозом).
- Grade 2 (G2) обозначает умеренную степень дифференцировки опухоли.
- Grade 3 (G3) обозначает низкую степень дифференцировки опухоли.
- Grade 4 (G4) — анапластическая, недифференцированная опухоль. Наихудший прогноз.
Симптоматика рака зависит главным образом от месторасположения опухоли, от темпов её роста, наличия метастазов.
Наиболее частыми признаками являются:
- Изменение кожных покровов на ограниченном участке в виде растущей припухлости, окружённой каймой гиперемии. Припухлости могут изъязвляться, обнажая глубокие язвы, нечувствительные к лечению.
- Изменение тембра голоса, затруднение глотания или прохождения пищи через пищевод, упорный кашель, боль в области грудной клетки или живота.
- Потеря массы, снижение аппетита, немотивированная слабость, стойкое повышение температуры тела, анемия, уплотнение молочной железы и кровянистые выделения из соска, кровянистые выделения из мочевого пузыря, затруднение мочеиспускания и т. д.

Своевременное обращение к врачу, тщательный сбор анамнеза, проведение внимательного осмотра пациента часто способствуют выявлению рака на ранних стадиях, поддающихся лечению. Особое внимание следует уделять выявлению предопухолевых заболеваний (пигментная ксеродермия, эритроплазия Кейра, меланоз Дюбрея, врождённый множественный полипоз толстой кишки), наличие которых предполагает как лечение, так и постоянный контроль за состоянием здоровья больного[9].
Для выявления опухоли применяются все доступные диагностические методы, например:
Лечение рака зависит от типа опухоли, её локализации, строения, стадии заболевания в соответствии с классификацией TNM.
Различают следующие типы лечения:
- Хирургическое удаление опухоли с прилежащими тканями. Эффективно для лечения опухолей небольших размеров, доступных для хирургического вмешательства, и при отсутствии метастазов. Нередко после хирургического лечения могут возникать рецидивы опухоли.
- Лучевая терапия применяется для лечения малодифференцированных опухолей, чувствительных к радиации. Также применяются для локального разрушения метастазов.
- Химиотерапия используется для лечения различных, зачастую, поздних стадий рака с использованием цитотоксических средств, гормональных/антигормональных средств, иммунных препаратов, ферментных препаратов, противоопухолевых антибиотиков[10] и других лекарственных препаратов, которые разрушают или замедляют рост раковых клеток.
- Генная терапия наиболее современный метод лечения, суть которого заключается в воздействии на систему STAT (signal transduction and activator of transcription) и другие системы, тем самым регулируя процесс деления клеток.
- Нейтронная терапия — новый метод лечения опухоли, похожий на лучевую терапию, но отличающийся от неё тем, что используются нейтроны вместо обычного облучения. Нейтроны проникают глубоко в ткани опухоли, поглотившие, например, бор, и уничтожают их, не повреждая при этом здоровые ткани в отличие от радиотерапии. Данная терапия показала очень высокий процент полного выздоровления в лечении опухолей, составляющий 73,3 % даже на запущенной стадии.[источник не указан 1821 день] Ученым новосибирского Института ядерной физики СО РАН удалось уничтожить 99 % опухолевых клеток в ходе эксперимента по лечению рака с помощью ускорителя для бор-нейтронозахватной терапии.[11]
- Иммунотерапия. Иммунная система стремится уничтожить опухоль. Однако она в силу ряда причин часто не в состоянии это сделать. Иммунотерапия помогает иммунной системе бороться с опухолью, заставляя её атаковать опухоль эффективнее или делая опухоль более чувствительной. Вакцина Вильяма Коли, а также вариант данной вакцины — пицибанил, являются эффективными при лечении некоторых форм новообразований благодаря стимулированию активности натуральных киллеров и выработке ряда цитокинов, таких как фактор некроза опухоли и интерлейкин-12[12][13]. Для активации защитных иммунных механизмов может применяться эпигенетическая терапия[14][15][16][17].
- Фотодинамическая терапия — в основе лежит применение фотосенсибилизаторов, которые избирательно накапливаются в клетках опухоли и повышающих её чувствительность к свету. Под действием световых волн определённой длины эти вещества вступают в фотохимическую реакцию, что приводит к образованию активных форм кислорода, который действует против клеток опухоли.[18]
На данный момент наиболее хорошие результаты в лечении рака наблюдаются при использовании комбинированных методов лечения (хирургического, лучевого и химиотерапевтического)[19].
Перспективным направлением в лечении являются методы локального воздействия на опухоли, такие как химиоэмболизация.
В июне 2016 года газета Australian сообщила, что международная группа ученых «близка к разработке универсальной вакцины против рака». Препарат, о котором идет речь, будет эффективным в отношении всех раковых заболеваний. По словам Угура Сахина, директора института изучения онкологических заболеваний Майнцского университета имени Иоганна Гутенберга, ученым впервые удалось создать внутривенную вакцину с использованием наночастиц. Он также рассказал, что она имеет не превентивный, а «терапевтический характер», и призвана не предотвращать раковые заболевания, а использоваться при их лечении. По его словам, вакцина уже прошла «обнадеживающие тесты» на мышах и нескольких людях, больных меланомой. Однако окончательные результаты её воздействия на этих больных людях будут известны примерно через год. После этого исследователи планируют провести более масштабные тесты на больных людях. Угур Сахин предположил, что препарат будет разрешен к применению «примерно через пять лет».[20]
В августе 2018 года австралийские ученые разработали вещество, воздействующие на белки KAT6A и KAT6B, способствующие развитию раковой опухоли. Клинические исследования показали, что новое вещество лишает раковые клетки возможности начинать клеточный цикл. Участник исследования профессор Энн Восс уточнил, что ингибитор приводит клетки рака к старению, и они теряют способность к делению и размножению. Лабораторные тесты на мышах с раком крови показали, что вещество увеличило продолжительность жизни животных в четыре раза, а также предотвратило рост и распространение злокачественных опухолей. ДНК-тест выявил, что ингибитор никак не повлиял на здоровые клетки организма. На основе полученных данных ученые начали разработку лекарственного препарата, способного «усыплять» раковые клетки.[21][22]
Прогноз для больных раком зависит от множества факторов: своевременное обнаружение опухоли, её локализация, стадия развития, уровня медицинского обслуживания в стране (регионе) и т. д. Выявление рака на ранних стадиях развития, как правило, ведёт к полному выздоровлению больного под действием адекватного лечения. Наличие распространённых метастазов, как правило, определяет неблагоприятный прогноз.
- ↑ Блохин Н. Н., Петерсон Б.Б. Клиническая онкология, М., 1979
- ↑ Рак (рус.). Всемирная организация здравоохранения. Дата обращения 25 марта 2019.
- ↑ Неандертальцы тоже страдали от рака, выяснили ученые (неопр.). РИА Новости (6 июня 2013). Дата обращения 3 мая 2014.
- ↑ Breasted J. The Edwin Smith Surgical Papyrus. — Chicago: University of Chicago Press, 1930. — Vol. 1. — P. 363—463.
- ↑ Гиппократ. Эпидемии, Кн. VII, 111 // Сочинения. Пер. В. И. Руднева. М., 1936. Т. 2, с. 260.
- ↑ Hippocrates. Vectiarius, part 1. // The Genuine Works of Hippocrates. Ed. C. D. Adams. New York, 1868.
- ↑ Ранняя история рака. История рака. Пер. с англ. Н. Д. Фирсова (2016).
- ↑ World Health Organization. The 10 leading causes of death in the world, 2000 and 2012 (неопр.). Death: Top 10 causes (2014). Дата обращения 17 августа 2015.
- ↑ Картер Р. Л. Предраковые состояния, перевод с англ. М., 1987
- ↑ Противоопухолевые антибиотики (неопр.). Энциклопедия лекарств и товаров аптечного ассортимента. РЛС Патент. — Инструкция, применение и формула.
- ↑ ТАСС: Сибирь — Новосибирские ученые успешно провели эксперимент по лечению рака с помощью ускорителя
- ↑ YOSHIKI RYOMA, YOICHIRO MORIYA, MASATO OKAMOTO, ISAO KANAYA, MOTOO SAITO and MITSUNOBU SATO et al. Biological Effect of OK-432 (Picibanil) and Possible Application to Dendritic Cell Therapy (англ.) // Anticancer Research (англ.)русск. : journal. — 2004. — Vol. 24. — P. 3295—3302. — PMID 15515424.
- ↑ McCarthy, E.F. The Toxins of William B. Coley and the Treatment of Bone and Soft-Tissue Sarcomas (англ.) // The Iowa orthopaedic journal : journal. — 2006. — Vol. 26. — P. 154—158. — PMID 16789469.
- ↑ Vendetti, Frank P.; Charles M. Rudin. Epigenetic Therapy in Non-small-cell Lung Cancer: Targeting DNA Methyltransferases and Histone Deacetylases (англ.) // Expert Opinion on Biological Therapy (англ.)русск. : journal. — 2013. — Vol. 13, no. 9. — P. 1273—1285. — doi:10.1517/14712598.2013.819337.
- ↑ Huili, Li. Immune Regulation by Low Doses of the DNA Methyltransferase Inhibitor 5-azacitidine in Common Human Epithelial Cancers (англ.) // Oncotarget (англ.)русск. : journal. — 2014. — Vol. 5, no. 3.
- ↑ Foulks, J.M.; et al. Epigenetic Drug Discovery: Targeting DNA Methyltransferases (англ.) // Journal of Biomolecular Screening (англ.)русск. : journal. — 2012. — Vol. 17, no. 1. — P. 2—17. — doi:10.1177/1087057111421212.
- ↑ Li, Y.; S.C. Casey, D.W. Felscher. Inactivation of MYC Reverses Tumorigenesis (англ.) // Journal of Internal Medicine (англ.)русск.. — 2014. — doi:10.1111/joim.12237.
- ↑ Photodynamic Therapy for Cancer (англ.). National Cancer Institute. Дата обращения 12 августа 2015.
- ↑ Волосянко М. И. Традиционные и естественные методы предупреждения и лечения рака, Аквариум, 1994
- ↑ ТАСС: Наука — Ученые близки к созданию универсальной вакцины против рака
- ↑ Inhibitors of histone acetyltransferases KAT6A/B induce senescence and arrest tumour growth
- ↑ Разработано вещество, способное «усыпить» раковые клетки
[2] [3] Нутатирующая опухолевая канцероидная субстанция; опухоль доброкачественная, но все же, 9.92020 [3] Позитивная семейная симптоматика, в том числе печатная версия: uno nodul nou apărut, анормал sângerări, предварительная оценка, опыт и специализация в разных сферах деятельности: 900 Признак существования симптомов рака желудка, горшок ацесте апареаи дин каза альтор проблематика. [4] Существующий вред 100 разным типам лечения рака.. se numără anumite инфекция, expunere la radiații ionizante olui poluanților de mediu. [5] țn țările ñn curs de dezvoltare aproape 20% от рака молочной железы, каузат, инфекция, гепатит В, до 2000 лет, вирус гепатита 2, 9 лет, 20 лет, инфекция, гепатит 2, инфекция, гепатит 2, инфекция, гепатит 2, инфекция, гепатит 2, инфекция, гепатит 2, инфекция, гепатит 2, инфекция, гепатит 2, инфекция, гепатит 2, инфекция, гепатит 2, инфекция, гепатит 2, инфекция, гепатит 2, инфекция, гепатит 2, вирус гепатита 2. factori acționează, cel puțin parțial, prin modificarea genelor unei celule. [2] Канадский департамент по борьбе с раком и его раковые заболевания. [6] Диаграмма 15 и более ранних диагнозов в высшей степени экономического образования. [14] в раковых заболеваниях в Стейт-Лайн, штат Калифорния, США, 66% от общего числа. [15] global. [6] Acestea au rezultat около 8,2 тысяч лет назад 14.6% din totalul deceselor umane. [6] [16] Целый май по раку легких, рак молочной железы, рак легочной артерии, рак простаты, рак толстой кишки, рак толстой кишки, рак желудка, рак молочной железы, рак молочной железы ulș maul ma cancer cancer, cancer cancer cancer cancer cancer pul.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9.9212121212121212121212121212121212121212121212121212121212121212121212121212121 me me me me me 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 din 17.9 40 40 40 40.9.9.9 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 40 ] [18] La copii leucemia limfoblastică acută tumori ile ile ile tumor le tumor tumor exce tumor tumor tumor tumor tumor tumor su nt Afric Afric Afric Afric Afric Afric Afric Afric [24]
În Europa de Vest, 10% дин-казурил от рака по-бразильски 3% -с казурил от рака из-за его атрибутов исконного происхождения, алкоголь, специальная раковая гепатика, доказанный диагноз
[25] По сути дела, местные власти провоката — 2–20% Дантре Казури, [26] год и 200 000 делц [27] .Dietă stii stil de viață [изменить] | modificare sursă]
Radiații [modificare | modificare sursă]
Infecții virale [модификация | modificare sursă]
Cauzele virotice ale diverselor типури де рак:
Обновить [модифицировать | modificare sursă]
Factori fizici [modificare | modificare sursă]
Cauze hormonale [modificare | modificare sursă]
Alte cauze [Модификационные | modificare sursă]
Etapa de inițiere [modificare | modificare sursă]
Asupra celulelor acționează factori mutageni. [2] Канадский департамент по борьбе с раком и его раковые заболевания. [6] Диаграмма 15 и более ранних диагнозов в высшей степени экономического образования. [14] по ракушечному заболеванию в Соединенных Штатах Америки, 66% от общего числа детей до 900% [30]
Tratamentul profilactic [модификация | modificare sursă]
Profilaxia primară при раковых заболеваниях, опухолях и вертлужных впадинах, устранении факторов риска.В отношении вируса папилломы человека (16-18 лет), чувствительного к мажоритарной канцеролии (приблизительно 70%). S-a dovedit că Vacinarea înainte ca organulus să vină ín contact with aceste tipuri de virus (adică înainte de începutul vieții sexuale) împiedică, инфекция ulterioară previ, является первичным заболеванием, распространенным в качестве прецизионной инфекции. Легкое заболевание, самооценка и системная вакцинация, а также развитие заболеваний, связанных с раковой опухолью, и устранение проблем, связанных с болезнью, ацетор, тип 2, тип рака.
Profilaxia secundară vizează depistarea bolii prin metode de screening in stadiile incipiente, preanceroase, care sunt curabile prin tratament специфический. Метод обследования скрининга рака. Приводит к рассмотрению рентгенологическое исследование легочной артерии. Методика скрининга рака молочной железы, в том числе цитологического, Babeș-Papanicolau, уход за модой, идеальный, для женщин, сексуальных, активных, сексуальных и сексуальных.
ro.wikipedia.org
[1] Симптомы саркомы матки включают необычное влагалищное кровотечение или образование влагалища. [2]
Факторы риска развития рака эндометрия включают ожирение, метаболический синдром, диабет 2 типа и семейную историю заболевания. [1 ] Факторы риска развития саркомы матки включают в себя предшествующую лучевую терапию таза. [2] Диагноз рака эндометрия обычно основан на биопсии эндометрия. [1] Диагноз саркомы матки можно заподозрить на основании симптомов, обследование таза и медицинская визуализация. [2]
Рак эндометрия часто можно вылечить, в то время как саркому матки обычно труднее лечить. [3] Лечение может включать в себя сочетание хирургического вмешательства, лучевой терапии, химиотерапии, гормональной терапии и таргетной терапии. [1] [ 2] Чуть более 80% людей выживают более 5 лет после постановки диагноза. [4]
В 2015 году около 3,8 миллиона человек были затронуты во всем мире, и это привело к 90 000 смертей. [5] [6] Рак эндометрия относительно часто встречается при саркоме матки. [3] В Соединенных Штатах Америки они составляют 3,6% новых случаев рака. [4] Они чаще всего встречаются у женщин в возрасте от 55 до 74, [4]
Causes []
Не известно точно, каковы могут быть причины рака матки, хотя гормональный дисбаланс считается фактором риска. Считается, что рецепторы эстрогена, присутствующие на поверхностях клеток этого типа рака, взаимодействуют с гормоном, вызывая повышенный рост клеток, который затем может привести к раку.
Стандартизированная по возрасту смертность от рака тела матки на 100 000 жителей в 2004 году. [8]
нет данных
менее 0,5
0,5–1
1–1,5
1,5–2
2–2,5
2,5–3
3–3,5
3,5–4
4–4,5
4,5–5
5 –8
более 8
Рак матки поражает приблизительно 3,1% женщин в течение жизни. [4] Рак матки привел к 45 000 смертей во всем мире в 1990 году, причем это число увеличилось до 58 000 смертей в 2010, [9] В Северной Америке и Северной Европе самые высокие показатели рак матки.Азия, Южная Европа, Австралия и Южная Америка имеют умеренные показатели, при этом самые низкие показатели наблюдаются в Африке и Восточной Азии. [10] Около 81% женщин с раком матки выживают в течение пяти лет. Этот показатель выше при более локализованном раке при 95% выживаемости в течение пяти лет и ниже при отдаленном распространении рака, при 16,8% выживаемости в течение пяти лет. [4]
Соединенное Королевство []
Рак матки является четвертым по распространенности раком среди женщин в Великобритании (около 8500 женщин было диагностировано с этим заболеванием в 2011 году) и является десятой по частоте причиной смерти от рака у женщин (в 2012 году умерло около 2000 человек).
en.wikibedia.ru
